
Визначення активності НПС-ферментів
Важливо розуміти особливості оцінки активності ферментів різними виробниками — активність НПС-ферментів у лабораторних умовах не гарантує їх ефективність у практичній годівлі.
Моногастричні тварини не здатні розщеплювати некрохмальні полісахариди (НПС) через відсутність відповідних ферментів у їх шлунково-кишковому тракті. Через високий уміст НПС у злакових й інших рослинних компонентах, додавання їх у раціон може негативно впливати на засвоюваність поживних речовин і показники продуктивності. Для зниження їх негативної дії в раціони моногастричних додають ферменти. Приклади НПС і НПС-ферментів наведено в табл. 1.
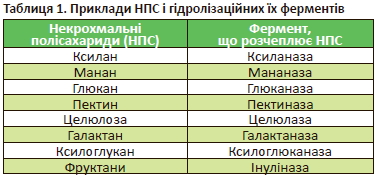 |
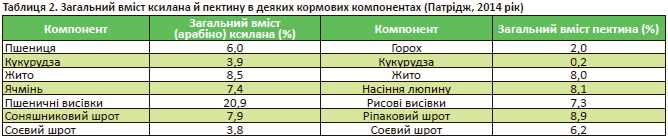
Наприклад, загальний уміст ксилана в кормових компонентах може перевищувати 20%, манана — 35, пектину — майже 9, а глюкана — 8% (табл. 2).
У природі існує низка мікроорганізмів-кандидатів, які можуть бути використані для розробки НПС-ферментів. Якщо мова йде про практичну годівлю тварин, то все це природне різноманіття обмежено кількома десятками придатних для цієї мети ферментів. Проте різні комерційні НПС-ферменти можуть значно відрізнятися за своєю ефективністю in vivo (в шлунково-кишковому тракті тварин). Їх ефективність може залежати від резистентності ферменту до дії протеолітичних ферментів (наприклад, пепсину в шлунку), його специфічності до субстрату, максимальної активності в діапазоні рН, що відбувається в шлунку моногастричних, від термостабільності ферменту під час процесу грануляції комбікорму тощо.
 |
Вимірювання активності НПС-ферментів у годівлі
Аналіз активності ферментів у годівлі використовується для двох цілей:
1) ідентифікації та доказу наявності певного ферменту в продукті, преміксі або комбікормі;
2) визначення кількості ферменту в пробі.
Придатними субстратами для визначення активності, наприклад, ксиланази й глюканази можуть бути різні ксилани й глюкани. Вимірювана активність ферменту прямо залежатиме від температури, значення pH, часу інкубації, кількісного співвідношення фермент/субстрат і виду субстрату під час вимірювання.
Здебільшого вимірювання активності НПС-ферментів відбувається шляхом їх інкубації з відповідним субстратом і подальшим визначенням продуктів гідролізу (відновлювальних цукрів) за допомогою калориметричних методів.
В інших фотометричних методах можна використовувати принцип зв’язку субстрату зі спеціальним барвником. За контакту ферменту з таким субстратом відщеплюється водорозчинна зафарбована субодиниця, й зміну забарвлення розчину можна заміряти фотометрично.
Імуноферментним аналізом вимірюється наявність або концентрація молекул у розчині за використання так званих антитіл, або антигенів. Цей метод є дуже чутливим, але вимагає наявності спеціальних імунних сироваток. Ба більш, він не дає можливості відрізняти активні від неактивних (деактивованих) ферментів.
Визначення активності НПС-ферментів може також ґрунтуватися на вимірі в’язкості. Такий метод використовує здатність ферментів знижувати в’язкість стандартного розчину певного субстрату (наприклад, арабіноксилану) за заданих умов за одиницю часу. Знаючи час падіння, наприклад, спеціальної кульки в тестованому розчині, можна розрахувати активність ферменту. Перевагою методу є те, що в ньому використовується так званий in vivo-ефект, тобто як у шлунково-кишковому тракті: за введення ферментів у разі значного вмісту водорозчинних НПС в складі комбікорму відбувається поліпшення перетравності поживних речовин і продуктивності.
Визначення поняття «Активність НПС-ферментів»
На сьогодні не існує єдиного стандартного методу для визначення активності НПС-ферментів. Кожен виробник використовує власний підхід, а також умови для аналізу (рН, температуру, субстрат тощо). Логічною одноманітністю є наявність характерного для кожного виробника поняття — одиниця активності ферментів (табл. 3). Відповідно, одиницю активності ферменту одного виробника не можна порівнювати з іншим.
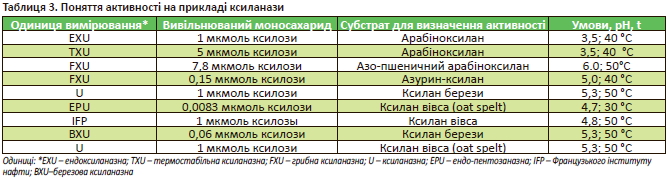 |
Так, визначення однієї термостабільної ксилазної одиниці (TXU) позначає кількість ферменту, яку вивільняє 5 мкмоль відновлювальних цукрів, вимірюваних еквівалентом ксилози на хвилину з 1%-го арабіноксілана за температури +40 ° C і рН = 3,5 в умовах тесту (табл. 3).
Вплив умов визначення активності на результати аналізу
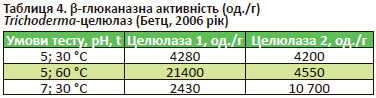 |
Як було згадано раніше, вимірювана активність НПСферменту прямо залежатиме від умов (рН, температура, субстрат тощо) під час аналізу. Залежно від температури й рН активність ферменту може суттєво змінюватися (табл. 4).
Як видно з табл. 4, активність целюлази 1 за підвищення температури від 30 до 60 °C (за однакового значення рН) збільшилася в 5 разів (з 4280 до 21 400 од./г), а активність целюлази 2 за зміни рН із 7 до 5 (за однакової температури) зменшилася у 2,5 раза (з 10700 до 4200 од./г). Іншими словами, один і той самий НПС-фермент може мати різну активність in vitro (у пробірці) залежно від температури або рН під час аналізу.
Не менш важливим показником є субстрат, що використовується під час визначення активності (табл. 5).
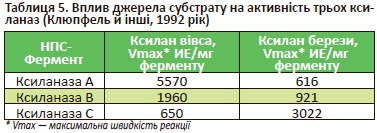 |
У табл. 5 показано, що одна й та сама ксиланаза залежно від використовуваного субстрату має різну активність.
Тобто виробнику НПС-ферменту для годівлі тварин і птиці досить змінити умови (наприклад, pH або субстрат) аналізу, якщо він має на меті збільшити активність ферменту, зазначену, наприклад, у технічній документації. Логічно зробити висновок, що в цьому немає сенсу, бо це буде той самий НПС-фермент або продукт, хоча цифри (активність) на папері можуть відрізнятися (наприклад, 4280 vs 21 400 од. /г, табл. 4).
Активність ферменту in vitro не є індикато ром його ефективності в організмі тварини
Навіть найкращий in vitro-тест не може повністю симулювати умови в шлунково-кишковому тракті тварини. Активність ферментів визначається за заданих контрольованих умов у лабораторії (рН, температура тощо), які відрізняються від умов в шлунково-кишковому тракті. Так, ви не знайдете температуру +50 °C в шлунковому тракті тварин і птиці, хоча вона є стандартом для оцінювання активності низки комерційних НПС-ферментів у лабораторії. До того ж умови в шлунково-кишковому тракті не постійні, вони змінюються. Так, рН в м’язовому шлунку бройлерів може варіюватися від 1,9 до 4,5. У шлунково-кишковому тракті присутні травні ферменти (наприклад, протеази), які можуть руйнувати ферменти.
У той час, як для визначення їх активності в лабораторії використовують очищені субстрати (наприклад, ксилан вівса), в кормових компонентах ці субстрати пов’язано з іншими, можуть мати іншу структуру або бути недоступні для дії НПС-ферментів. Ба більше, деякі субстрати для визначення активності в лабораторії (наприклад, ксилан берези) взагалі не присутні в кормових компонентах.
Так, для реєстрації всіх кормових ферментних добавок у Європейському Союзі необхідна обов’язкова наявність наукового підтвердження їх ефективності in vivo, яке передбачає подачу спеціального досьє у Європейське агентство з безпеки харчових продуктів (EFSA). Особа, яка подає досьє для реєстрації продукту, має надати як мінімум три експерименти по кожному виду тварин і птиці, що підтверджують ефективність ферментного препарату in vivo.
Тому об’єктивним способом оцінки й порівняння різних НПС-ферментів є тільки проведення відповідних дослідів на тваринах. На основі, наприклад, показників продуктивності та/або перетравності поживних речовин в кінці експерименту, а також з урахуванням вартості рекомендованих доз продуктів на тонну комбікорму, можна дійти висновку про їх ефективність та/або доцільність застосування.
Визначення активності ферменту методом, що не є для нього стандартом
Усі виробники ферментів використовують свої власні методи аналізу активності для різних проб (чистий продукт або в складі преміксу, комбікорму). Це дозволяє їм проводити контроль активності в різних умовах і давати рекомендації щодо застосування для господарств.
У табл. 6 наведено результати дослідження різних НПСферментів віскозиметричним методом.
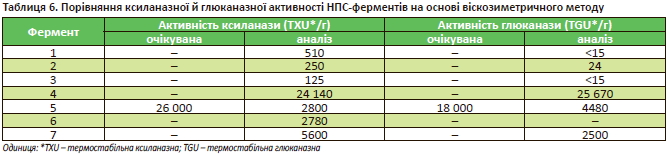 |
З табл. 6 видно, що активності ферментів можуть значно відрізнятися. Цей віскозиметричний метод є стандартом для визначення активності тільки для ферменту 7. Спроба визначити активність інших ферментів цим самим методом веде до значних відхилень від очікуваного значення. Очікувана активність — та, що дає виробник у технічній документації й рекомендаціях згідно із заявленим методом її визначення. Так, для ферменту 5 очікувана виробником активність ксиланази має становити 26 000 од./г, в той час як вимірювана віскозиметричним методом дорівнює тільки 2800 од./г. Цей результат абсолютно логічний, тому що ми використовували для визначення активності ферменту 5 інший метод з іншими умовами.
Тому визначення активності ферменту методом, який не є для нього стандартом, не має сенсу. Таке дослідження може дозволити оцінити тільки відносну термостабільність ферменту. Так, знаючи активність НПС-ферменту в комбікормі до і після процесу грануляції, можна розрахувати відсоток втрати активності ферменту під час грануляції і не більше.
Вибір відповідного нпс-ферменту для годівлі тварин
Під час скринінгу потенційних НПС-ферментів — кандидатів для годівлі тварин на початкових етапах розробки продукту, справді, доводиться використовувати методи in vitro (у пробірці), бо часто з тисяч ферментів-кандидатів нам потрібно вибрати лише один десяток. In vitro — методи дозволяють нам імовірно оцінити, як певний фермент поводитиметься in vivo. Проте, щоб зробити остаточний вибір ферменту для виробництва, потрібно провести кілька експериментів на тваринах (in vivo) за одночасного використання, наприклад, усіх десяти кандидатів у кожному з експериментів. Часто обранцем виявляється фермент, що має не найвищу активність in vitro (у пробірці) за заданих умов. Такий шлях у виборі ферменту для комерційних продуктів проходять одиничні компанії у світі. Однак це забезпечує останнім, а також їх продуктам, перевагу проти аналогічних продуктів на ринку.
Таким чином, підсумовуючи сказане вище, можна дійти таких висновків:
• існує безліч методів визначення активності НПС-ферментів у годівлі. У всіх них використовуються різні підходи й умови під час аналізу;
• умови (температура, рН, субстрат тощо) під час визначення активності ферментів істотно впливають на результати аналізу;
• використання певного методу визначення ферментів у комбікормі для різних комерційних продуктів дає можливість оцінити й порівняти їх за термостабільністю під час грануляції й не більше;
• активність НПС-ферментів у лабораторних умовах однозначно не гарантує їх ефективності в організмі тварин і птиці (тобто in vivo).
Щоб дійти висновку про ефективність того чи іншого ферменту, потрібно дослідити на тваринах.
Євген Шастак, д-р аграрних наук, BASF SE, відділ годівлі тварин (Лампертхайм, Німеччина)
журнал “Наше Птахівництво”, січень 2019 року
Усі авторські права на інформацію розміщену у журналі “Наше птахівництво” та інтернет сторінці журналу за адресою https://agrotimes.ua/journals належать виключно видавничому дому «АГП Медіа» та авторам публікацій, згідно Закону України “Про авторське право та суміжні права”.
Використання інформації дозволяється тільки після отримання письмової згоди від видавничого дому «АГП Медіа».







 Наше Птахівництво
Наше Птахівництво