
Новий погляд на хворобу Ньюкасла

Комплексне використання живих, інактивованих та векторних вакцин від хвороби Ньюкасла сприяє формуванню певного рівня клітинного та гуморального захисту, ефективність якого залежить від схеми імунізації, типу вакцини, епізоотичної ситуації та особливостей менеджменту.
Хвороба Ньюкасла посідає значуще місць серед низки захворювань у птахів. Збудник продовжує адаптуватися і спричиняти хворобу, незважаючи на впровадження новітніх імунологічних препаратів та досконалих схем вакцинації. Враховуючи відмінності менеджменту птахофабрик у різних державах світу, наявність перельотних птахів та значних зон їх міграції, ерадикація хвороби Ньюкасла досі є глобальною проблемою та ендемічною інфекцією для більшості країн Азії, Східної Європи, Африки, Центральної та Північної Америки, а кількість спалахів, спричинених високовірулентним вірусом хвороби Ньюкасла з IX та VII геногруп, зростає з кожним роком.
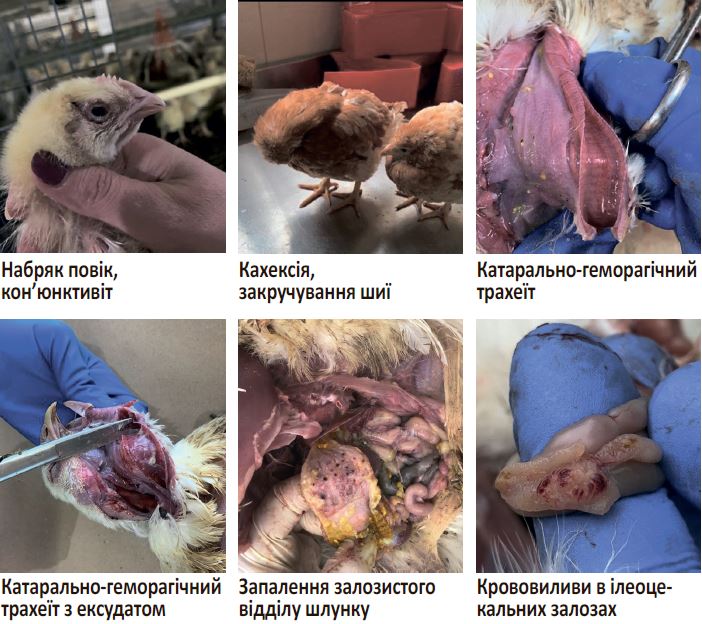
Вірус хвороби Ньюкасла належить до родини Paramyxoviridae 1 серотипу, його генетичний матеріал представлений одноланцюговою несегментованою РНК, що забезпечує відносно низький рівень мутації. За ступенем та характером клінічних проявів розрізняють такі патотипи: асимптоматичний кишковий, лентогенний, мезогенний та велогенний. Вірулентні штами вірусу зазвичай характеризуються індексом інтрацеребральної патогенності (ICPI), що визначається на добових курчатах і перевищує значення 0,7 одиниці. Лентогенні штами (ICPI ≤ 0,7) спричиняють лише незначні респіраторні прояви у молодих курчат, водночас мезогенні (ICPI = 0,7–1,5) призводять до більш виражених патологічних змін і середнього рівня смертності. Інфікування велогенними штамами (ICPI > 1,5) викликає діарею, крововиливи у шлунково-кишковому тракті, респіраторні та нервові клінічні ознаки зі смертністю до 100%. Велогенний патотип, своєю чергою, поділяється на велогенний вісцеротропний та велогенний нейротропний субтипи. Слід зазначити, що не лише показник ICPI характеризує вірулентність патогену. Важливим при характеристиці вірусу крім ICPI є такі параметри: середній час смерті (MDT) — визначають шляхом введення суспензії вірусу в алантоїс 10-денних ембріонів, і є середнім проміжком часу, під час якого гине ембріон (велогенний < 60 год, мезогенний — 60–90 год, лентогенний > 90 год) та внутрішньовенний індекс патогенності (IVPI) — середній бал на птицю після внутрішньовенного зараження 10 курчат віком 42 дні, що враховує кількість хворих та загиблих тварин протягом 10 днів. Вірус може прикріплюватись, проникати та розмножуватись в епітеліальних клітинах трахеї, кишківника, легень, шлунку; ендотеліальних клітинах; імунних клітинах селезінки, Гардерієвої та ілеоцекальної залози, бурсі; нейроглії та астроцитах центральної нервової системи, спричиняючи різноманітні клінічні та патолого-анатомічні зміни (фото). Прикріплення забезпечується HN-протеїном, який має нейромінідазну та гемоаглютиназну активність (руйнує сіалові рецептори і запобігає злипанню вірусних часток). Крім того, патоген за допомогою F глікопротеїну проникає в середину клітин макроорганізму та спричинює їх злиття та гемоліз. Інфекційна здатність та активність вірусу залежить від місця розрізання протеїну — попередника F0 у амінокислотній позиції 112–117 на два гетеродимери, об’єднані дисульфідними зв’язками, а саме: F1 та F2. Розрізання протеїну F0 відбувається за участі трипсинових або фуринових протеаз, у патогенних ізолятів цей процес зазвичай проходить за залишком фенілаланіну у позиції 117 (112R/G/K-R-Q/K-K/R-R↓F117), у низьковірулентних штамів за залишком лейцину (112G-R/K-Q-G-R↓L117).
Слід зазначити, що точкові мутації спричинюють амінокислотні заміни у послідовності білка F0. Це може кардинально вплинути на сайти розпізнавання для протеаз, що індукуватиме появу нових штамів із різним ступенем вірулентності. Цікавий факт, що F0 протеїн низько-вірулентних штамів розрізається протеазами верхніх дихальних шляхів та шлунково-кишкового тракту птахів; високовірулентних — будь-якими протеазами організму птахів, що сприятиме системній інфекції. Крім F та HN протеїну на ступінь патогенності вірусу хвороби Ньюкасла впливає V протеїн, який інгібує активність інтерферону, тим самим пригнічує розвиток гуморальної імунної відповіді та захисних властивостей макроорганізму.
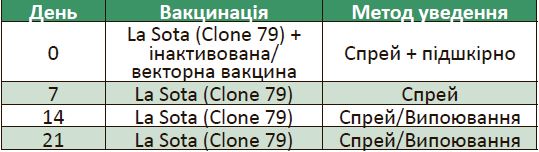
Наразі існує значна кількість генотипів вірусу хвороби Ньюкасла, що диференціюють у результаті секвенування генів, які відповідають за синтез F0 протеїну. Досить часто виникають спалахи хвороби Ньюкасла, спричинені велогенними штамами вірусу, генотип яких відмінний від вакцинних штамів, що ставить під сумніви ефективність використання класичних вакцин. Однак незалежні дослідження групи винахідників на чолі з Woo-Jin Jeon 2008 року, а також вчений Garcia 2013 року, Cheng Y 2016 року встановили факт ефективності різних штамів Ла Соти проти велогенних субпопуляцій ІІІ, IV, V, VII, VIII та IX генотипів. Особливість контролю у разі детекції VII, VIII та IX генотипів полягає в ущільненні схем імунізації від хвороби Ньюкасла завдяки комплексному використанню живих вакцин на основі респіратропних штамів, а також інактивованих або векторних вакцин (таблиця 1). Це необхідно для зниження персистенції та вірусовиділення патогену на фабриці.
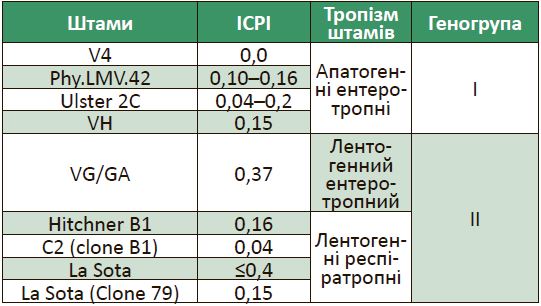
Розрізняють значну кількість штамів вірусу хвороби Ньюкасла, що входять до складу живих вакцин, використання яких призводить до формування певного рівня клітинного, місцевого (секреторні імуноглобуліни) та системного (нейтралізуючі антитіла) гуморального захисту у птиці (табл. 2).
Механізм дії вакцин
Після застосування спрей-вакцинації (крапля ≥ 170–200 мкм) в інкубаторі формується лише клітинний імунітет та секреторні імуноглобуліни у респіраторному та шлунково-кишковому тракті, відбувається так званий праймінг. Слід пам’ятати, що за використання респіратропних штамів захищеність дихальної системи більше, ніж у разі введення апатогенних ентеротропних штамів, оскільки останні діють переважно в кишківнику. Перша імунізація на фабриці призводить до бурстування клітинного захисту та зниження рівня материнських антитіл, який безпосередньо впливає на напрацювання гуморальної імунної відповіді, що активно починає формуватися лише після другої живої вакцини (активації В-клітин пам’яті). Гуморальний імунітет після живих вакцин формується лише тоді, коли концентрація вірусу в дозі перевищує 105 EID50. Чим більше концентрація вірусу у дозі, тим більше рівень гуморального захисту. Цікавий факт, що через 3–5 днів після наступної вакцинації від вірусу хвороби Ньюкасла рівень антитіл дещо знижується, що пов’язано з їх витратою на зв’язування з вакцинним вірусом. Максимальний захист від вищезгаданої хвороби формується через 14 днів після застосування живих вакцин, його тривалість становить 3–4 тижні.
Інактивовані вакцини забезпечують утворення високого гуморального захисту через 3–4 тижні після уведення. Ефективність інактивованих вакцин напряму залежить від ад’юванту, який підсилює імунну відповідь та впливає на її швидкість. Саме ад’ювант стимулює міграцію антигенпрезентуючих клітин у місце введення вакцини, тим самим підсилює місцеву клітинну відповідь та пришвидшує презентацію антигену, активацію В-клітин у плазматичні, що синтезують антитіла. Слід зазначити, що фізичні властивості самого розчину вакцини, тип суспензії, є вирішальними для тривалості роботи імунобіологічного препарату. Менш реактогенними і достатньо імуногенними із поступовим вивільненням антигену вважають суспензії по типу масло/ вода або вода/масло/вода. Інактивовані вакцини, формуючи високий гуморальний захист, знижують тиск польового вірусу хвороби Ньюкасла на фабриці.
Векторні вакцини є проривом у галузі імунопрофілактики птиці, оскільки повністю безпечні та стимулюють розвиток гуморальної відповіді. Наразі існують наступні типи векторних вакцин від хвороби Ньюкасла: на основі вірусу віспи, герпесвірусу індички та вірусу хвороби Ньюкасла. Слід зазначити, що векторні вакцини на основі вірусу віспи чутливі до материнських антитіл, а наявність контакту з вірусом віспи зменшує ефективність вакцинації. Вакцини на основі герпесвірусу активуються досить довгий період часу, близько 4–5 тижнів, формування антитіл відбувається вже тоді, коли материнські антитіла зникають. Активний період роботи захисту — 4–5 тижнів. Вакцини на основі вірусу хвороби Ньюкасла як носія стимулюють утворення швидкого клітинного і гуморального захисту, однак вони взаємодіють із материнськими антитілами, що інактивує частину препарату, тим самим знижує його ефективність.
Який метод вакцинації обрати
Важливим для досягнення ефективного захисту окрім типу вакцини є й метод її уведення. Метод «закапування в око» вважається найбільш ефективним, однак і трудомістким. У результаті відбувається безпосереднє потрапляння вірусу на Гардерієву залозу, де накопичується значна кількість В-лімфоцитів, що пришвидшує презентацію антигену і забезпечує утворення високого гомогенного захисту. За окулярного введення, як і під час спрей-вакцинації, формується місцевий клітинний імунітет, секреторні імуноглобуліни IgA, IgY у верхньому респіраторному тракті, трахеї, легенях, а також розвивається системний гуморальний захист.
Імунізація методом випоювання сприяє формуванню місцевого клітинного захисту і секреторних імуноглобулінів IgA, IgY переважно у кишківнику, формуванню менш вираженого, як порівняти з вищезгаданими методами вакцинації, гуморального імунітету. Необхідно враховувати те, що одна якісна вакцинація спрей-методом чи шляхом випоювання забезпечить лише до 53–60% захисту в стаді, що пов’язано з особливістю групових методів імунізації та необхідністю бустерної дози для синтезу достатнього рівня антитіл. Дієвого захисту можна досягти лише у разі отримання не менше 85 % від рівня колективному імунітету. Саме тому залежно від епізоотичної ситуації однієї вакцинації на полі буває недостатньо.
Доволі часто на фабриці перевага надається методу випоювання, ніж спрей-вакцинації, оскільки він вважається більш простим і з меншою ймовірністю розвитку небажаних поствакцинальних проявів. Однак це не так. Доцільно враховувати високу ймовірність ролінгу (через не дозоване потрапляння вірусу до птиці та неоднорідність імунізації); нижчий рівень гуморального захисту, ніж після попадання вакцини на цільові респіраторні органи; місцевий клітинний захист більшою мірою утворюється в кишківнику, а не у вхідних воротах інфекції.
Крім того, для проведення якісної імунізації не слід забувати про чистоту системи для пиття, особливості будови лінії (низький тиск у кінці пташнику), поведінкові особливості птиці, висоту підняття поїлок, якість освітлення, отримання спраги, температуру води для розчинення вакцини (до 18–20 °С) та контроль якості вакцинації (наявність фарбування язиків більше нуж у 95% вибірки).
На якість спрей-вакцинації також впливає значна кількість чинників, які обов’язково потрібно контролювати: світло, групування птиці, вентиляція, наявність вторинної бактеріальної інфекції респіраторного тракту, розмір краплі (для першої вакцинації > 150 мкм). Хоча дрібною краплею легше провести однорідну імунізацію та забезпечити ефективне покриття, особливо за умов утримання птахів у клітці, така крапля потрапляє у нижні відділи респіраторного тракту та повітроносні мішки, що підвищує ймовірність появи небажаних поствакцинальних реакцій. Проникаючи в легені, вакцинний вірус реплікується у альвеолярних макрофагах, тим самим знижує їх активність та пригнічує клітинну ланку первинного захисту. Це підвищує сприйнятливість до вторинних бактеріальних інфекцій. Розмір краплі залежить не лише від форсунки, але й від температури, вологості, вентиляції у пташнику, тиску у спрей-апараті, відстані від форсунки до голови птиці.
Таким чином, імунізація з використанням живих, інактивованих та векторних вакцин сприяє формуванню певного рівня клітинного та гуморального захисту від хвороби Ньюкасла, який буде варіювати залежно від обраного методу та схеми імунізації, типу вакцини, наявності імуносупресорів та значної кількості супутніх особливостей менеджменту. Саме груповий імунітет, захищеність не менше 85% від кількості імунізованої птиці відіграє важливу роль у стійкості до захворювання на рівні стада.
Олексій Нечипуренко, Ольга Іващенко, канд. біол. наук, спеціалісти з технічної підтримки Laboratorios Hipra, S. A.
журнал «Наше Птахівництво», липень 2020 року
Усі авторські права на інформацію, розміщену у журналі “Наше Птахівництво” та інтернет-сторінці журналу за адресою https://agrotimes.ua/ належать виключно видавничому дому «АГП Медіа» та авторам публікацій згідно із Законом України «Про авторське право та суміжні права».
Використання інформації дозволяється тільки після отримання письмової згоди від видавничого дому «АГП Медіа».






 Наше Птахівництво
Наше Птахівництво